田辺三菱製薬のニュースは、当社関連の最新情報をステークホルダーの皆様にお伝えするために実施しています。医療用医薬品や開発品の情報を含む場合がありますが、報道関係者等への情報提供を目的としたものであり、これらはプロモーションや広告、医学的なアドバイス等を目的とするものではありません。ニュースに記載している情報は、発表日時点のものです。現時点では、発表日時点での情報と異なる場合がありますので、あらかじめご了承ください。
ニュースリリース
HGF遺伝子治療用製品「コラテジェン®筋注用4㎎」新発売のお知らせ
2019年9月4日
田辺三菱製薬株式会社(本社:大阪市中央区、代表取締役社長:三津家正之、以下「田辺三菱製薬」)とアンジェス株式会社(本社:大阪府茨木市、代表取締役社長:山田英、以下「アンジェス」)は、重症虚血肢を対象としたHGF遺伝子治療用製品「コラテジェン®筋注用4㎎」(一般名:ベペルミノゲン ペルプラスミド、以下「コラテジェン®」)について、本日、薬価基準に収載されたことを受け、9月10日(火)に新発売することをお知らせいたします。
コラテジェン®は、アンジェスが設立以来手がけてきた主力のプロジェクトで、2019年3月26日に、慢性動脈閉塞症の潰瘍の改善を効能、効果又は性能として条件及び期限付製造販売承認を取得した国内で初めての遺伝子治療用製品です。コラテジェン®は、ヒト肝細胞増殖因子(HGF)を発現するプラスミドDNAであり、標的細胞である下肢の筋肉細胞内に取り込まれ、細胞内で転写・翻訳されて、HGFを産生・分泌します。HGFの血管新生作用によって、虚血部位の血管数と局所血流量を増加させ、虚血状態を改善させます。
田辺三菱製薬とアンジェスは、2015年6月、HGF遺伝子治療用製品の販売に関し、日本国内における末梢性血管疾患を対象とした独占的販売権許諾契約を締結しており、田辺三菱製薬が販売を担当します。コラテジェン®の承認は、条件及び期限付であり、製造販売後承認条件評価を期限の5年内に実施し、本承認を取得することが課せられています。田辺三菱製薬はアンジェスから委託され、製造販売後承認条件評価として使用成績比較調査を実施します。
田辺三菱製薬とアンジェスは、コラテジェン®の本承認取得をめざすことにより血行再建術の施行が困難な慢性動脈閉塞症の潰瘍における新たな治療選択肢を提供するとともに、本製品に係る適正使用を推進し、重症下肢虚血患者さんの QOL 向上に貢献してまいります。
- 「コラテジェン®筋注用4㎎」の製品概要
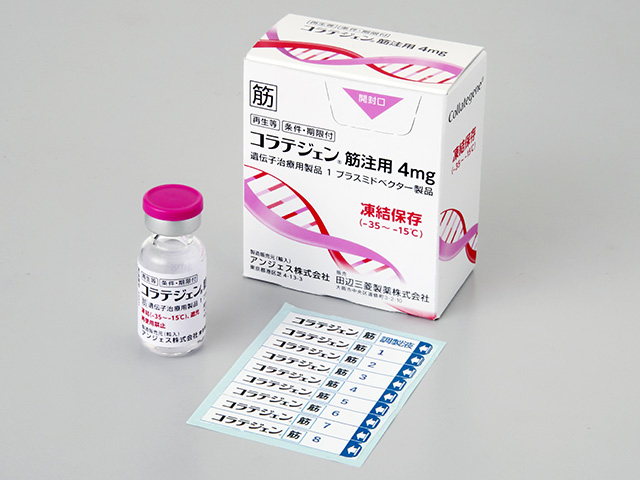
【製品概要】
販売名 コラテジェン®筋注用4㎎
一般名 ベペルミノゲン ペルプラスミド
【効能、効果又は性能】
標準的な薬物治療の効果が不十分で血行再建術の施行が困難な慢性動脈閉塞症(閉塞性動脈硬化症及びバージャー病)における潰瘍の改善
【用法・用量】
通常、成人には、投与対象肢の虚血部位に対して1カ所あたり本品0.5㎎を8カ所に4週間間隔で2回筋肉内投与する(1回総計4㎎)。なお、臨床症状が残存する場合には、2回目投与の4週後に3回目の投与を行うこともできる。また、投与に際しては、日局生理食塩液で希釈し、希釈後の1カ所あたりの薬液量は3mLとし、投薬対象筋が小さい場合には2mLまで減じてよい。
【承認条件及び期限】
<承認条件>
①重症化した慢性動脈閉塞症に関する十分な知識・治療経験を持つ医師のもとで、創傷管理を複数診療科で連携して実施している施設で本品を使用すること。
②条件及び期限付承認後に改めて行う本品の製造販売承認申請までの期間中は、本品を使用する症例全例を対象として製造販売後承認条件評価を行うこと。
<期限>
5年
【薬価】
600,360円/1バイアル
【製造販売承認日】2019年3月26日
【薬価基準収載日】2019年9月4日
【製造販売元】アンジェス株式会社
【販売元】田辺三菱製薬株式会社
田辺三菱製薬株式会社 広報部
報道関係者の皆様
TEL : 06-6205-5119
株式市場関係者の皆様
TEL : 06-6205-5110
アンジェス株式会社
経営企画部 広報・IR担当
TEL : 03-5730-2641
