プレシジョンメディシンの定義と社会的意義
「適切な医療を、適切なタイミングに、適切な患者さんに届けること」をプレシジョンメディシンの定義とし、患者さんの治療満足度を高め、社会保障にも貢献します
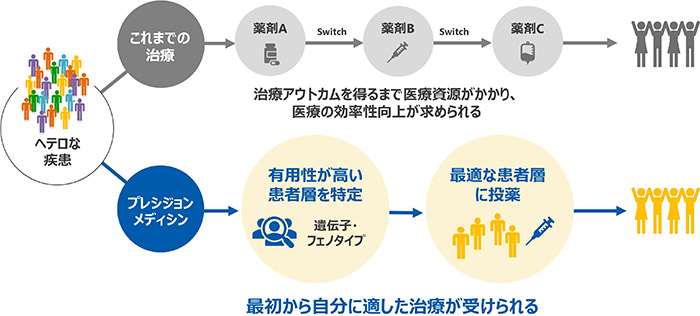
「適切な医療を、適切なタイミングに、適切な患者さんに届けること」をプレシジョンメディシンの定義とし、患者さんの治療満足度を高め、社会保障にも貢献します

このサイトでは、より良いコンテンツの提供を目的にクッキーを使用しています。サイトの閲覧を続けることでクッキーの使用に同意したことになります。
プライバシーポリシー