
社会 > 患者さん・医療関係者の皆さまとともに 医薬品安全性/信頼性保証
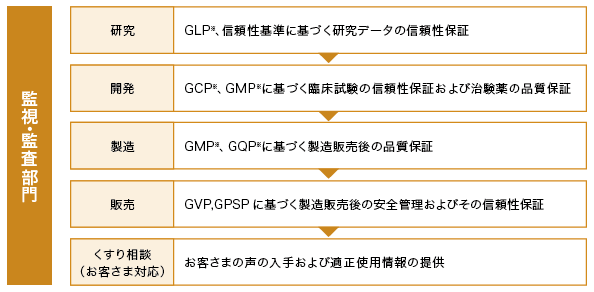
医薬品における信頼性保証体制
2020年4月、製品に関する“品質と安全管理”のグローバルヘッド機能としてQV(Quality & Vigilance)本部を設立しました。QV本部の役割は、下記のとおりです。
QV本部の主な役割
- 高い品質の製品を安定供給するための体制・仕組み・システムの構築
- 研究~開発~市販後における各業務の信頼性担保のための監査
- 製品および開発品の安全性情報の収集と分析およびその報告・周知
- 市販後製品の安全性情報調査方針策定とその推進

- 医薬品の「安心と信頼」を追求し、
企業価値の向上に貢献します。 - QV本部 本部長メッセージはこちら
QV本部では、医療関係者や患者さんに安心して医薬品をご使用いただくために、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」はもとより、GLP、GCP、GMP、GQP、GDP、GVP、GPSPなどの各種法令等を遵守し、信頼性保証体制の維持・向上に努めています。
2017年5月、米国において筋萎縮性側索硬化症(ALS)治療薬のエダラボンの承認を取得したことを皮切りに、その後もスイス、カナダなどでも承認を取得し、これまで製品の自販体制※のなかった地域への製品展開を加速しています。これまで以上に各国の品質部門、安全性部門と連携しながら各国規制を遵守して製品を提供しています。また、医療環境の違いなども常に念頭に置き、安心して使用いただける製品を世界の人々に提供しています。
当社グループは、法令の遵守と信頼性保証体制の維持・向上により医薬品等の品質、有効性および安全性を確保していきます。
※海外ライセンス供与企業による販売に加え、直接販売を行える体制のこと。自販体制が構築されると、製薬会社として自立した活動が可能になります。
※GLP(略語:Good Laboratory Practice)
医薬品の安全性に関する非臨床試験の実施の基準。
※GCP(略語:Good Clinical Practice)
医薬品の臨床試験の実施の基準。
※GMP(略語:Good Manufacturing Practice)
医薬品及び医薬部外品の製造管理及び品質管理の基準。
※GQP(略語:Good Quality Practice)
医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準。
※GVP(略語:Good Vigilance Practice)
医薬品、医薬部外品、化粧品、医療機器及び再生医療等製品の製造販売後安全管理の基準。
※GPSP(略語:Good Post-marketing Study Practice)
医薬品の製造販売後の調査及び試験の実施の基準。
新製品の安全管理
新薬の販売開始後には、臨床試験では見出せなかった副作用が発現することがあります。当社は、これらの情報を早期に収集・分析のうえ、医療現場にフィードバックし、新たな安全対策を講じる予測予防型の安全管理活動を推進しています。これらの活動が新製品の副作用の拡大を未然に防止し、医療現場での適正使用につながると考えています。
さらに、海外で使用される場合、日本とは異なる医療環境等で使用されることになるため、その安全管理には慎重を期す必要があります。
たとえば、当社が創製したエダラボンは、2001年に脳梗塞急性期の治療薬として日本で承認され、20年以上にわたり日本で使用されてきました。2015年以降は、ALS治療薬として日本および米国を含む海外においても使用されています。
このように当社には、これまでに蓄積してきた豊富な安全性情報に基づき、適正使用を推進してきた貴重な経験があります。この経験を最大限に活かし、また海外における規制や医療環境にも配慮して、適切、安全に使用されるよう安全性情報の収集と提供に努め、ALS患者さんのQOL向上に貢献していきます。
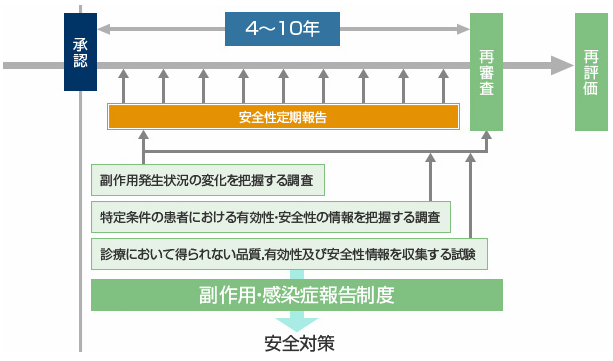
製造販売後調査の実施について
医薬品は臨床試験をはじめとしたさまざまな試験成績を基に、規制当局から承認を得て、販売が開始されます。臨床試験は、新薬の有効性と安全性を科学的に検証するために必要十分な患者数をもって実施されます。しかし、臨床試験の参加条件(年齢、既往歴、併用薬等)は、必ずしも市販後の使用条件と同一ではありません。
そこで、当社では、新薬の販売開始後から医療現場における使用実態下での安全性情報の収集を開始するとともに、各種の製造販売後調査を実施しています。これら調査を通して、実際に医療現場で処方された新薬に関するデータを集めることにより医薬品の安全性と有効性の検討を積み重ね、そこから得られる情報を迅速かつ的確に規制当局および医療関係者にフィードバックすることで、医薬品を適正に使用していただけるように努めています。
医薬品の品質確保
世界に通用する品質システムを構築し、高品質で信頼される製品の安定供給を通じて、健康で豊かな暮らしを願う世界の人々に貢献することをポリシーとし、GMP(医薬品及び医薬部外品の製造管理及び品質管理の基準)およびGQP(医薬品、医薬部外品、化粧品及び医療機器の品質管理の基準)などを遵守しています。従業員一人ひとりが患者さんの安全を第一に考え、結果だけでなくプロセスを重視した品質確保を推進し、国内外製造所の管理・監督・指導を通じて、市場に出荷する製品の品質向上に取り組んでいます。
また、「医薬品の製造販売承認書に則した製造等の徹底について(平成28年6月1日付厚生労働省課長通知)」に基づき、医薬品の品質確保に努めています。
何より患者さんの安全を確保し不利益を防止するために、製品の安全性や有効性、品質、表示などに問題が見つかった場合には、速やかに監督官庁へ報告するとともに、医療機関などに情報提供し、その製品を回収する体制を整えています。
2024年度の自主回収は0件でした。
医薬品が患者さんに安心して使用いただける品質であることに加えて、患者さんが必要なときに医薬品を供給することも当社の重要な使命の一つですので、2021年度から製品回収の件数を当社グループのマテリアリティのモニタリング指標として設定し、医薬品の安定供給に努めています。
品質確保のための取り組み
- 製造所との連携やチェック体制を強化し、承認書と製造実態を定期的に確認
- 製造所における自己点検や自らの調査に基づき、不備があれば是正・改善を図ることで、再発防止対策を徹底
医薬品・安全性教育
当社は、経営層と全従業員を対象に、医薬品の安全性に関する知識の蓄積・継承と意識向上に取り組んでいます。
2024年度においても、経営層と全従業員を対象に医薬品の安全管理や薬害事件に関する教育研修を実施しました。この研修により、製薬企業で働く者として、私たち一人ひとりがリスクに対する感性を高め、常に患者さんの健康と安全を最優先に考え、高い倫理観を持って行動することを再認識しました。
